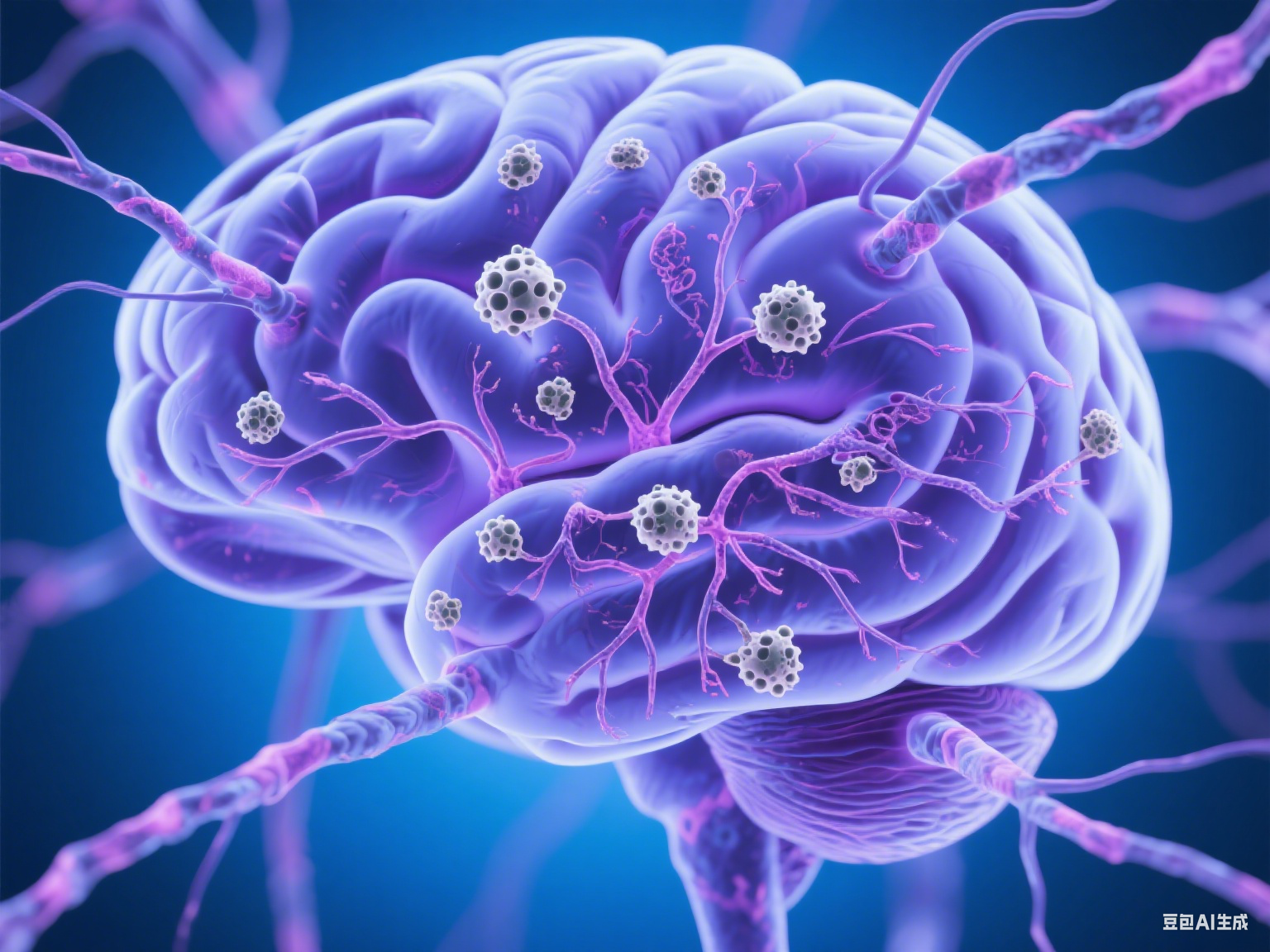
脑内的“沉默杀手”:β-淀粉样蛋白的聚集过程
阿尔茨海默病的早期病变往往隐秘而缓慢,其中最具代表性的标志,是脑内β-淀粉样蛋白(β-amyloid)的异常积聚。β-淀粉样蛋白是一种由APP(淀粉样前体蛋白)裂解产生的小分子肽段,本应被正常清除,但在阿尔茨海默病患者体内,由于酶的异常剪切、代谢障碍等原因,β-淀粉样蛋白在脑组织间隙中积聚,形成“淀粉样斑块”。
这些斑块像微小的毒瘤,聚集在神经元周围,对神经元产生化学毒性,干扰细胞间的信息传递。不仅如此,它们还会诱导周围免疫细胞活化,触发慢性炎症反应,加速神经细胞死亡。研究表明,斑块最早可在海马体等与记忆密切相关的区域形成,解释了阿尔茨海默病初期的“短期记忆缺失”现象。
例如,一位70岁退休教师,原本每天坚持写日记和阅读,但逐渐开始忘记书本内容、重复写下同一段文字。影像检查显示其大脑海马体区域已有明显的β-淀粉样蛋白沉积。
神经网络的崩塌:tau蛋白与神经纤维缠结
除淀粉样斑块外,另一个显著病理特征是神经纤维缠结(neurofibrillary tangles)。这与tau蛋白的异常磷酸化有关。正常情况下,tau蛋白存在于神经细胞的微管系统中,负责稳定细胞结构与轴突运输功能。然而,在阿尔茨海默病中,tau蛋白被过度磷酸化,导致其脱离微管、缠结成团,破坏了神经元内部运输系统。
结果是,神经元难以维持正常的营养与能量供应,最终陷入功能障碍甚至凋亡。随着缠结在大脑皮层、内嗅皮层、扣带回等区域的扩展,患者不仅记忆力减退,语言、判断、行为控制能力也相继受损。
一位曾任银行会计的阿尔茨海默病患者,起初仅表现为粗心出错,后来连日常开支都难以规划,甚至将冰箱误认为保险箱。这种认知错乱,正是神经网络崩塌的生理投射。
突触的“失联”:信息传递的中断与功能衰退
大脑的运作依赖于上百亿个神经元之间的突触连接。突触不仅是“信息传输站”,更是学习、记忆与情绪调节的关键环节。在阿尔茨海默病中,这些突触逐步萎缩、数量锐减,信号传递能力随之下降。
研究发现,突触功能受损,往往早于神经细胞死亡发生,且与认知能力下降高度相关。β-淀粉样蛋白可直接干扰突触内钙离子稳态,削弱信号传递效率。与此同时,tau缠结也使得神经元内结构紊乱,进一步加剧突触断裂。
更令人关注的是,即使没有形成大面积神经死亡,突触的局部“失联”也足以引发临床症状。比如一位60岁的女企业家,连续出现会议内容记不住、熟悉同事名字忘记等“轻度认知障碍”表现,影像学检查中发现其突触密度明显下降,而总体脑容量尚未严重萎缩。
炎症与免疫:过度反应的“双刃剑”
大脑并非免疫“特区”,其中存在一类称为小胶质细胞(microglia)的免疫细胞,在神经系统中担任“清道夫”角色,负责识别、清除死亡细胞与病理沉积物。在阿尔茨海默病患者体内,小胶质细胞被β-淀粉样蛋白与tau蛋白激活,释放大量炎症因子,如白细胞介素-1、肿瘤坏死因子等。
这种持续的低度慢性炎症,会进一步破坏神经组织,加剧细胞凋亡。一方面,免疫系统试图“修复”,但另一方面,其反应过度也造成“友军误伤”,反而加速病情进展。
一些研究者指出,阿尔茨海默病的大脑炎症模式与系统性自身免疫疾病存在相似性。例如,多发性硬化、系统性红斑狼疮患者在罹患阿尔茨海默病的风险更高。这提示我们,炎症并非仅仅是“后果”,而是推动病理链条的活跃因子。
遗传与环境:双重力量塑造疾病风险
尽管绝大多数阿尔茨海默病属于散发型,但也有10%左右为家族遗传型,其发生与基因突变密切相关。其中,APOE ε4等位基因是最重要的易感因子。携带1个ε4等位基因者患病风险为普通人的3倍,双等位基因携带者风险高达12倍。
此外,PSEN1、PSEN2和APP基因突变,也会导致早发型阿尔茨海默病。这类患者往往在40岁至60岁即出现症状,且病程进展迅速。
不过,基因并非命运的唯一主宰。环境因素与生活方式同样起着决定性作用。长期高血压、糖尿病、肥胖、吸烟、缺乏运动、慢性睡眠障碍等,均被证实与发病风险升高密切相关。而高教育水平、社会参与度高、健康饮食习惯(如地中海饮食)等,则被认为具备“认知储备”功能,有助于延缓症状出现。
例如,一对双胞胎姊妹,其中一位长期参与社区志愿活动,保持阅读与写作习惯,而另一位早早退休后生活较为单调。十年后,后者患上阿尔茨海默病,而前者仍保持基本认知功能。这类“同基因、不同轨迹”的对比,揭示了环境对大脑健康的深刻影响。
从脑结构到人格变化:被遗忘的不只是记忆
阿尔茨海默病的进展不止是记忆衰退那么简单。随着疾病蔓延至额叶、顶叶与边缘系统,患者可能出现言语混乱、空间错觉、决策能力丧失、情感淡漠,甚至人格重塑。一些原本温和、有条理的人,可能变得冲动、易怒,甚至怀疑家人图谋不轨。
这些变化源自脑区功能的再配置。例如,额叶负责行为控制与道德判断,当其受损时,行为规范逐渐丧失;而边缘系统控制情绪与共情,受损则可能导致冷漠与不安。更晚期的患者,甚至会丧失对自我身份的认知。
曾有一位阿尔茨海默病患者,年少时曾是业余诗人,晚年却将窗外的大树认作敌人,在深夜大声呼喊“有人在监视我”。他的家人沉痛地表示:“他不是忘了我们,他是忘了自己。”
阿尔茨海默病终将带走语言、带走记忆,也带走一个人的世界。在医学无法彻底治愈这场疾病的今天,理解其脑部退化机制,是我们面对它、接纳它、延缓它最重要的第一步。
睡眠与清除系统:夜间大脑为何至关重要
近年来的研究发现,睡眠对阿尔茨海默病的预防和发展起着关键作用。大脑在清醒状态下不断产生代谢废物,其中就包括β-淀粉样蛋白。而在深度睡眠时,脑脊液流动速度显著加快,能够将这些有毒物质“冲洗”出大脑,这一过程被称为“脑淋巴系统”(glymphatic system)。
长期睡眠不足或质量低下,会严重干扰这一清除机制,导致β-淀粉样蛋白持续堆积,加剧神经损伤。此外,睡眠紊乱本身也是阿尔茨海默病的早期信号之一。有研究显示,患有慢性失眠、频繁夜醒、昼夜节律紊乱的人群,其认知功能下降的风险显著升高。
一位退休工程师在确诊阿尔茨海默病前十年,便常年受失眠困扰,夜间清醒次数频繁。其家属回忆:“他白天也疲惫不堪,却说脑子总像塞了东西。”这正是睡眠系统与脑清除机制失调的警讯。改善睡眠质量,或许就是对抗脑退化最平凡却有效的一步。